一場專利挑戰 讓國產痛風仿制藥“搶跑”十年
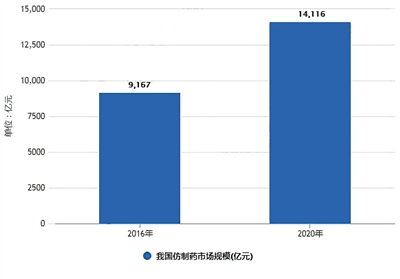
來源:前瞻經濟學人
日前,國家知識產權局發布《無效宣告請求審查決定書》,江蘇知原藥業有限公司(以下簡稱知原藥業)與南京華威醫藥科技集團有限公司共同作為無效宣告請求人,使得日本株式會社富士藥品(以下簡稱富士藥品)持有的“托呲司特晶型專利”在華專利權正式失效。
知原藥業研發副總裁付劼說:“這一仗打贏了,國產仿制藥托呲司特片有望提前10年上市!”
繞不過的專利雷區
痛風及高尿酸血症是繼高血糖、高血脂、高血壓之后的第“四高”病。據相關統計,國內高尿酸血症患者發病率為10%,痛風患者已超過8000萬人,此類疾病已成為我國第二大代謝類疾病。但遺憾的是,目前,國內抗痛風藥物品種不多,可供選擇藥物少。臨床治療主要以秋水仙鹼、非甾體類抗炎藥、激素、促進尿酸排泄藥和抑制尿酸合成藥為主。
在抗痛風的藥品中,托呲司特片堪稱一枝獨秀。2013年,該藥在日本被批准生產銷售,是一款溫和、安全、高效的降尿酸特效藥。不過,遺憾的是,直到目前為止該藥尚未在中國上市。但是,該藥的生產者富士藥品,卻早就在中國申請了托呲司特片的專利。
專家介紹,富士藥品圍繞托呲司特片,主要設置了兩項專利雷區,一項是化合物專利,2022年到期﹔而最關鍵的一項晶型專利,則要到2033年才到期。這是國際藥企經常採用的“專利網”戰術,目的就在於盡可能延長藥品的專利保護期,以獲取高額的利潤。這也意味著,中國藥企如果要仿制托呲司特片,必須要等到2033年之后。
知原藥業研發部負責人鮑豐祺告訴科技日報記者,也就是說,在2033之前,中國痛風病人隻能吃高價的進口藥品。早在2014年,知原藥業就開始啟動國產仿制藥托呲司特片的研制。面對令人望而生畏的專利“雷區”,他們最初的想法是繞路而行。“但是,很快發現,實在是繞不過去。”鮑豐祺說。
“仿制藥要和原研藥保持一致性,實現等效,如果在相同化合物成分的基礎上採用不同的晶型,藥品的溶解度就達不到要求,影響患者吸收,也就無法和原研藥的效能保持一致。”鮑豐祺說,要讓國產的好藥早點上市,此刻留給知原藥業的選擇隻有一個,發起專利挑戰,贏得發展空間。
民營藥企挑戰壟斷
“所謂‘專利挑戰’,是指在法律規定下,通過挑戰專利使仿制藥合法上市,打破原創藥的市場壟斷,使藥價得以降低。”常州第二人民醫院呼吸內科副主任張倩博士說。
記者了解到,早在2001年,國內就有企業針對美國輝瑞公司的藥品“偉哥”發起專利挑戰,歷經數載馬拉鬆式的拉鋸戰,最后還是鎩羽而歸。當然,目前也有正大天晴等公司的專利成功挑戰國際藥企的案例,但對於知原藥業這樣一個民營中小型藥企來說,向跨國藥企發起一場專利挑戰,還是屬於極罕見的案例。
用付劼的話來說:“發明專利是經過專利局審查授權的,要想反過來‘無效掉’它,難上加難。要麼檢索到新的對比文件,要麼找出審查員適用法律的錯誤。比方說,一個專利已經在十幾個國家授權,得到多個國家專利局審查員的認可,說明大家都認為它不存在實質性缺陷。現在想推翻這麼多技術、法律專家的意見,難度可想而知。”
為打這場仗,付劼和他的同事們付出了4年多的努力。實驗室裡的無數不眠之夜,上千次的試驗,他們終於找到日本藥企的專利保護存在一個致命缺陷,盡管是一個“小缺口”,卻使得為整個專利“續命”的晶型專利失去了嚴格意義上的獨創性。
后來的事實証明,這正是整個托呲司特專利挑戰過程中最關鍵的一個証據點。但和電影上經常出現的法庭交鋒不同,專利挑戰的本質是要用翔實的數據、嚴密的論証來解開對方的專利鎖鏈,把技術語言完美地轉換成法律語言。
為此,知原藥業專門聘請從業經歷豐富的專利律師,和技術團隊協同作戰。但富士藥品也有異常豐富的專利保護經驗,富士藥品聘請的律師,就是當年這項專利的代理人,對托呲司特片專利的熟悉程度遠超常人。雙方藥企開始了一場旗鼓相當的博弈。
2018年2月11日,知原藥業向專利復審委提出無效宣告請求。2018年8月27日,該案舉行第一次口頭審理,2019年2月18日,又進行了第二次口頭審理……看似波瀾不驚,但背后,是知原藥業團隊對法律文本一次又一次的打磨。“盡管難度很大,但是,我們越來越有信心,等待著勝利時刻的到來。”鮑豐祺說。
藥品研發打開新窗
“勝利總是屬於那些堅持到最后的人。”付劼說,“其實,2014年前后,國內進行托呲司特片仿制的藥企有20多家,但最后大多放棄了。”
“這次成功,也為我們公司藥品研發申報打開了一扇窗口,專利挑戰的神秘面紗被揭開,如果在產品開發過程中再涉及專利問題,我相信我們一定能夠勇敢面對,對原研大公司不再畏懼,而是敢於繼續挑戰。”付劼說。
長期從事專利訴訟的北京驥馳知識產權代理有限公司總經理唐曉峰說,美國、日本以及歐洲多個國家均有專利挑戰制度,國家的法律是允許的,政策上是支持的,手段上依靠的是無效請求人對專利技術和法律的深刻理解和運用。
專家指出,企業也應該注意,在專利挑戰前,要請專業的專利代理師做好充分的專利法律調研和分析工作,否則敗訴的可能性很大。
這一仗雖說打贏了,但採訪中付劼提出了另一個問題:在歐美日等藥品市場,一旦創新藥專利到期,必然有專利挑戰成功者促使其降價。但目前在中國,很多跨國藥企的產品雖然過了專利期,依然能夠以高價大行其道,致使在藥物使用、滿足患者方面呈現與其他國外市場不同的景象。
專家介紹,在美國,一直有“首仿”的概念,指第一個遞交、並在專利挑戰中殺出一條血路,最終獲批成為第一個上市的仿制藥。首仿藥最大的好處在於可以獲得180天的“首仿獨佔期”,在這期間,美國食品和藥物管理局(FDA)不會批准其他仿制藥的申請,而這180天往往使得首仿企業獲益匪淺。
唐曉峰說:“但是在中國,這一制度還一直‘缺失’。”
“隨著大量國外藥企的專利即將到期,對於中國具有研發實力的企業來說,或許現在有了新機遇。應盤點自身的研發管線,確定哪些專利挑戰產品進行加速研發。而如果能有一些制度上的鼓勵,相信對中國藥企特別是中小型企業的激勵作用應該很大。”付劼說。(過國忠)
分享讓更多人看到 
推薦閱讀
相關新聞
- 評論
- 關注





















 第一時間為您推送權威資訊
第一時間為您推送權威資訊
 報道全球 傳播中國
報道全球 傳播中國
 關注人民網,傳播正能量
關注人民網,傳播正能量